Lehrstuhl für Ernährung und Immunologie
Prof. Dr. rer. nat. Haller leitet den Lehrstuhl für Ernährung und Immunologie an der TUM School of Life Sciences der Technischen Universität München. Darüber hinaus leitet er als Direktor des ZIEL – Institute for Food & Health ein interdisziplinäres Zentralinstitut und den Sonderforschungsbereich Microbiome Signatures (SFB 1371) an der Technischen Universität München.
Der Darm steht im Fokus unserer Forschungsaktivitäten.
Ernährung und Mikrobiom
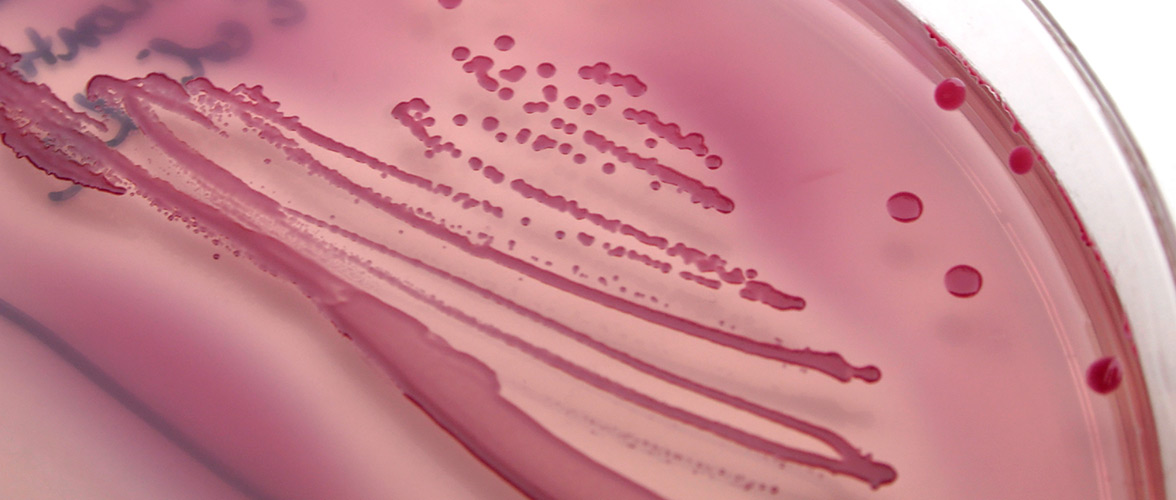
Das mikrobielle Ökosystem im Darm (Mikrobiom) spielt eine wichtige Rolle in der Entstehung chronischer Erkrankungen und die Ernährung beeinflusst die Zusammensetzung und Aktivität der Mikroben im Darm. Prospektiven Kohorten und Interventionsstudien bei Erwachsenen und Neugeborenen helfen Risikosignaturen zu identifizieren und die Rolle der Lebensmittel zu spezifizieren.
Diurnal rhythmicity of fecal microbiota and metabolite profiles in the first year of life: a randomized controlled interventional trial with infant formula. Cell Host & Microbe 2024 Jul 10;32(4):573-587.
Arrhythmic Gut Microbiome Signatures Predict Risk of Type 2 Diabetes. Cell Host & Microbe 2020 Aug 12;28(2):258-272.
Entzündung und Krebs
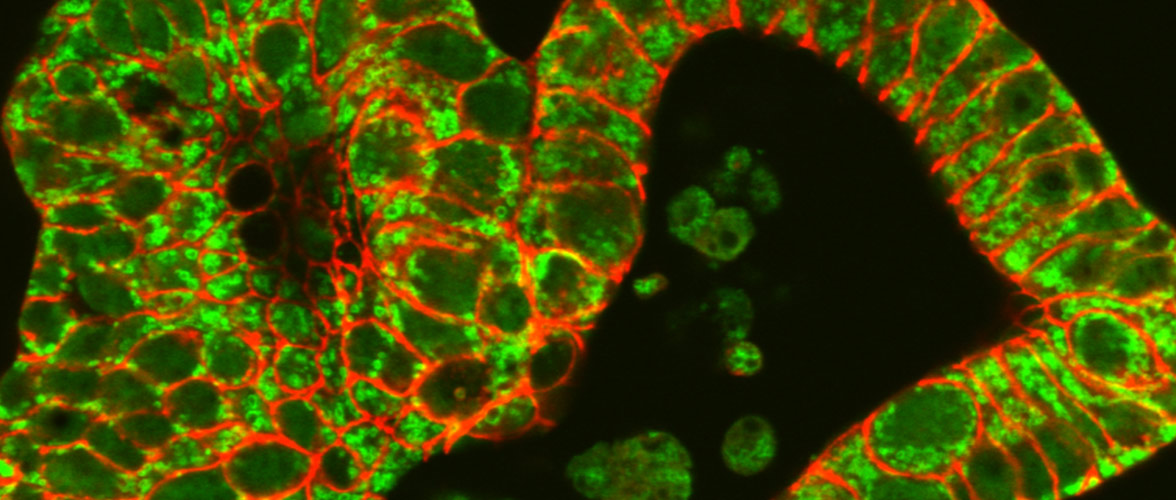
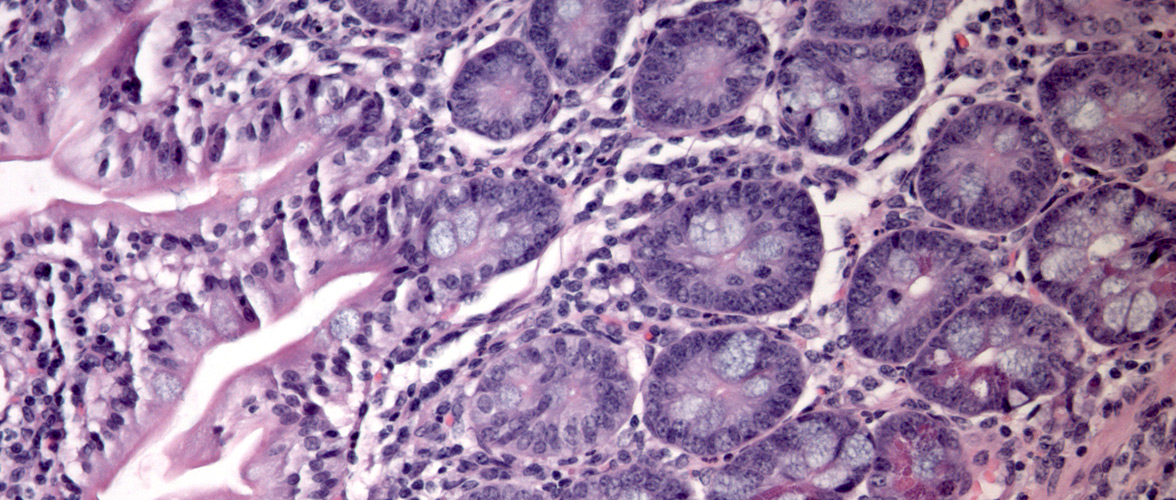
Funktionelle Änderungen im Mikrobiom sind ursächlich beteiligt sind an der Pathogenese chronischer Darmerkrankungen. Das Darmepithel als Barriere und Kommunikationsorgan steht dabei im Zentrum der Forschungsaktivitäten und keimfreie Tiermodelle für Morbus Crohn, Colitis ulcerosa und Krebs helfen die Mikroben-Wirt-Interaktion aufzuklären.
Mitochondrial perturbation in the intestine causes microbiota-dependent injury and gene signatures discriminative of inflammatory disease. Cell Host & Microbe 2024 Jul 10 doi: 10.1016/j.chom.2024.06.013
- Activated ATF6 Induces Intestinal Dysbiosis and Innate Immune Response to Promote Colorectal Tumorigenesis. Gastroenterology 2018 Nov;155(5):1539-1552.
Prävention und Therapie
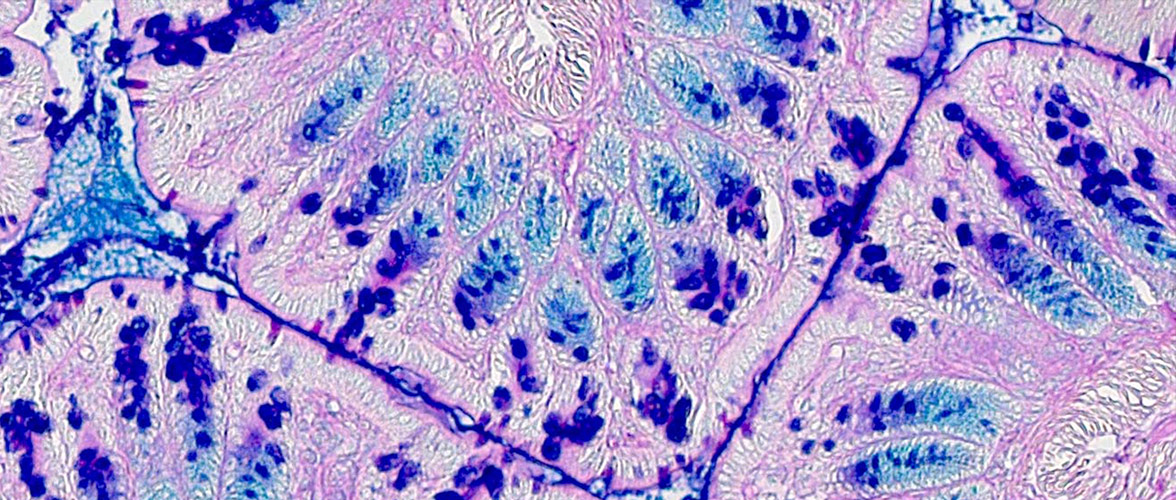
Metabolische Veränderungen der epithelialen Barriere beeinflussen die Pathogenese von Entzündungs- und Tumorerkrankungen. Der Transkriptionsfaktor ATF6 (Activating transcription factor 6) und die mitochondriale Stressantwort stehen dabei im Zentrum der Fragestellungen und therapeutische Wirkmechanismen von Metaboliten aus dem Mikrobiom und der Ernährung werden untersucht.
Exclusive Enteral Nutrition Initiates Individual Protective Microbiome Changes to Induce Remission in Pediatric Crohn’s Disease. Cell Host & Microbe. 2024 November 13.
Mitochondrial impairment drives intestinal stem cell transition into dysfunctional Paneth cells predicting Crohn's disease recurrence. Gut. 2020 Nov;69(11):1939-1951.